1. Die Krankheit
HPV: Was ist das eigentlich? HPV ist die Abkürzung für Humane Papillomviren Virus. Die HPV-Infektion ist eine der häufigsten sexuell übertragbaren Infektionskrankheiten weltweit. Es gibt viele verschiedene Gattungen von HPV Viren, die unterschiedliche Krankheiten zur Folge haben. Weil einige der Viruserkrankungen krebsauslösend sind, stellt HPV ein besonderes Gesundheitsrisiko dar.
1.1 Der Erreger
Die Humanen Papillomviren sind unbehüllte, doppelsträngige DNA-Viren, die zur Familie der Papillomviren gehören. Es gibt also nicht nur ein HPV- Virus, sondern ganz verschiedene Varianten des Virus, die auch unterschiedliche Krankheitsbilder hervorrufen können. Manche HPV-Varianten lösen recht harmlose Krankheitsverläufe aus. Allerdings gibt es auch sogenannte Hochrisiko-HPV-Typen, die Krebs auslösend sind.
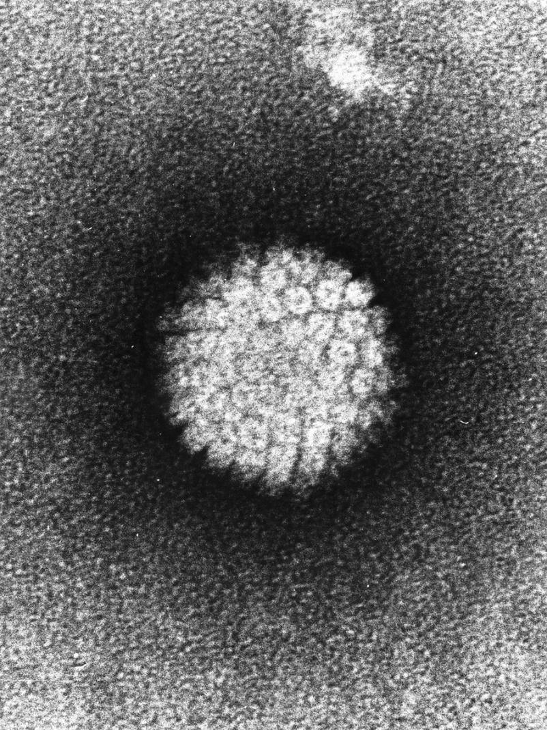
Abbildung 1: https://commons.wikimedia.org/wiki/File:Papilloma_Virus_(HPV)_EM.jpg (abgerufen: 09.11.2020)
Die Humanen Papillomviren aus der Familie der Papillomviren sind unbehüllte, doppelsträngige DNA-Viren. Sie werden in 5 Genera (vom Lateinischen Genus: Gattung) unterteilt: Alpha-, Beta-, Gamma-, Mu- und Nu-HPV. Mittlerweile wurden mehr als 200 verschiedene HPV-Typen entdeckt. Die HP-Viren können aufgrund ihres onkogenen („tumor-fördernden/erzeugenden“) Potentials in Hochrisiko- und Niedrigrisiko-Typen unterteilt werden. Die WHO (World Health Organization) kategorisiert derzeit zwölf Hochrisiko-HPV-Typen, die sicher karzinogen (krebs-auslösend) sind: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 und 59.(2) Zu den relevantesten Niedrigrisiko-Typen gehören die Typen 6 und 11, welche für die Entstehung von Genitalwarzen (Condyloma acuminata) verantwortlich sind.
Aufgrund eines fehlenden Stoffwechsels ist das Virus nicht in der Lage, sich allein zu vermehren. Somit kann es sich ausschließlich durch eine Wirtszelle ausbreiten.(3)
1.2 Epidemiologie: Verbreitung der HP-Viren
Die Krankheit HPV ist weit verbreitet - über die Hälfte aller Menschen infizieren sich damit. Nicht alle Krankheitsverläufe sind schlimm. Welche Symptome auftreten hängt davon ab, mit welchem Virus-Typ man sich angesteckt hat. Hat man sich mit einem Niedrig-Risikotyp des Virus angesteckt, können als Anzeichen Warzen im Genitalbereich auftreten. Gefährlicher sind die Hochrisikotypen: Die sind karzinogen, also krebs-auslösend. Doch wie steckt man sich mit HPV an? HPV wird von Mensch zu Mensch und beim Hautkontakt bzw. Kontakt mit Schleimhaut übertragen. Weil HPV eine sexuell übertragbare Krankheit ist, wird sie auch beim oder im Zusammenhang mit Geschlechtsverkehr übertragen.
Die Humane Papillomviren-Infektion ist eine der häufigsten sexuell übertragbaren Infektionskrankheiten weltweit. Über die Hälfte aller Menschen infizieren sich im Laufe ihres Lebens mit HPV.(4) Betroffen sind sowohl Männer als auch Frauen. Die meisten Erkrankungen werden durch die zwei Hochrisiko-Typen 16 und 18 verursacht. Darüber hinaus gibt es noch mindestens 12 weitere HPV-Typen, die Krebserkrankungen hervorrufen können. Ein Großteil der HPV-Typen kann außerdem Warzen verursachen. Die Infektion verläuft in den meisten Fällen asymptomatisch, weshalb nur ein Bruchteil der Infizierten eine HPV Erkrankung bemerken.
„Etwa 16% aller Krebserkrankungen weltweit sind infektionsbedingt; in den entwickelten Ländern liegt dieser Anteil bei ca. 7%, die Hälfte davon ist HPV-bedingt. Der häufigste HPV-induzierte Tumor ist das Zervixkarzinom (Tumor des Gebärmutterhalses), das weltweit den vierthäufigsten Tumor bei Frauen darstellt: 2012 war das Zervixkarzinom für etwa 528.000 Neuerkrankungen und 266.000 Todesfälle ursächlich. Etwa 85% dieser globalen Krankheitslast entfällt auf Entwicklungsländer, in denen HPV für fast 12% aller Tumore bei Frauen verantwortlich ist.“ (vgl. RKI-Ratgeber zu HPV(5)).
Basierend auf Daten des RKI (Robert Koch-Institut) erkranken in Deutschland jedes Jahr etwa 6.250 Frauen und ca. 1.600 Männer an Krebsarten, die durch HPV ausgelöst wurden. Allein im Jahr 2016 erkrankten 4.380 Frauen am Zervixkarzinom, welches beinahe zu 100% von HPV ausgelöst wird. Davon sterben ca. 1600 Frauen jährlich an den Folgen der Tumorerkrankung.(6) Das mittlere Erkrankungsalter mit bereits invasivem Karzinom beträgt 55 Jahre. Der Tumor ist dann bereits in benachbarte Gewebe eingedrungen. Eine Vorstufe, das noch räumlich auf eine Körperstelle begrenzte Krebsgeschwür, lässt sich oft deutich früher erkennen. Man spricht hierbei von einem Karzinom in-situ (CIN/CIS). Es wird meist schon 20 Jahre früher bei der Vorsorgeuntersuchung erkannt und kann dadurch besser behandelt werden als ein invasives Karzonom.
Bei Männern treten etwa 600 Anal- und mindestens 250 Peniskarzinome sowie mindestens 750 Karzinome im Mund- und Rachenbereich auf, welche durch HPV bedingt sind. (7)
Zu den Risikofaktoren gehören u.a. Rauchen und ein niedriger sozioökonomischer Status(8). Ein weiterer Risikofaktor sind Geburten im jungen Alter und die Anzahl der natürlich geborenen Kinder. Dabei sind, wie wahrscheinlich auch bei der Pille (9), als Confounder (Störfaktor in der Untersuchung eines Zusammenhangs) ein früher, ungeschützter Geschlechtsverkehr zu beachten. Das Infektionsrisiko steigt für die Frauen nach einer natürlichen Geburt, da sich nach der Geburt die Schleimhaut verändert und damit gegebenenfalls anfälliger für Infektionen wird. Das häufige Wechseln der Geschlechtspartner (Promiskuität) erhöht außerdem das Risiko einer Infektion. Allgemein gilt bei einer Immunschwäche ein erhöhtes Infektionsrisiko (10).
Die von den Niedrigrisiko-HPV-Typen verursachten Genitalwarzen treten bei etwa 1-2% der sexuell aktiven Erwachsenen zwischen dem 15. und 49. Lebensjahr auf. Die Daten aus Deutschland zeigen ein Lebenszeitrisiko von 5-10%. Unter Frauen ist die Inzidenz mit 627 Fällen pro 100.000 Personenjahre in der Altersgruppe der 20- bis 24-Jährigen am höchsten. Bei den Männern hingegen ist die Inzidenz mit 457 Fällen pro 100.000 Personenjahre bei den 25- bis 29-Jährigen am höchsten.(11)
1.3 Pathogenese: Übertragbarkeit der HPV-Viren
HPV wird über direkten Kontakt von Mensch zu Mensch übertragen. Die Viren dringen über Mikroverletzungen der Haut bzw. Schleimhaut in die Zellen ein. Hauptübertragungsweg ist ein Sexualkontakt. Die Sexualpraktiken können dabei den Infektionsort bedingen – z.B. begünstigt Analverkehr Läsionen, also kleine Verletzungen, in der entsprechenden Lokalisation. Frauen mit zervikaler HPV-Infektion übertragen die Viren dabei jedoch selten auf die Mundschleimhäute ihres Sexualpartners.12
Der Körper ist mit zahlreichen Mechanismen ausgestattet, die es Viren schwer machen, sich im Körper auszubreiten. Damit die HP-Viren in den Körper eindringen können, müssen sie durch eine Art Grenzgewebe. Dieses Gewebe wird Epithelgewebe genannt und in ihm finden sich Stammzellen. Für eine Ansteckung mit dem HP-Virus muss das Virus die Stammzellen erreichen. Das ist unter normalen Umständen nur an wenigen Körperstellen möglich, zum Beispiel den Mandeln im Mund-Rachen-Bereich oder der Gebärmutter. Auch verletzte Hautstellen machen es dem Virus leichter, in den Körper einzudringen. Je nachdem, mit welchem Typ des HP-Virus eine Ansteckung vorliegt, können unterschiedliche Symptome auftreten. Wichtig ist: Auch wenn nicht die typischen Symptome auftreten, sind infizierte Personen für andere ansteckend. Abhängig vom Virustyp können als Symptome Warzen im Bereich der Vagina oder des Afters, nach Oralverkehr auch im Bereich des Mundes auftreten. Eine Infektion mit HPV kann nicht nur Warzen hervorrufen - auch Gebärmutterhalskrebs kann durch manche HPV-Typen ausgelöst werden. Etwa 70 Prozent der Gebärmutterhalskrebserkrankungen werden durch die Hochrisiko-HPV-Typen 16 und 18 hervorgerufen.
Infizieren die Viren Schleimhautzellen, können sie die Regulation des Zellzyklus stören und lokal zu Zellwachstum (Proliferation) führen. Abhängig vom Virustyp können unterschiedliche Symptome auftreten. In den Zellen der Schleimhaut (Epithelzellen) können sogenannte intraepitheliale Neoplasien/Läsionen entstehen. Das heißt, dass sich in der Schleimhaut neues Gewebe gebildet hat. Dieses Gewebe kann sowohl gutartig als auch eine Krebsvorstufe sein. Diese Zellveränderungen haben insbesondere in den Anfangsstadien ein hohes, spontanes Rückbildungspotential und können deshalb von selbst verschwinden. Deshalb ist meistens am Anfang nur eine Kontrolle nötig. Erfolgt keine vollständige Ausheilung, so können sich je nach HPV-Typ Feigwarzen (Genitalwarzen) oder Krebserkrankungen (Gebärmutterhals-, Vaginal-, Anal-, Peniskrebs, sowie Mund und Rachenkrebs) entwickeln. Bis sich die Erkrankung im Gewebe ausbreitet vergeht meist viel Zeit: Die Latenzzeit vom Übergang in eine invasive Läsion dauert i.d.R. viele Jahre bis Jahrzehnte.(13)
Die Eintrittspforten für die Infektion mit HP-Viren sind dabei die sogenannten basalen Stammzellen eines Epithelgewebes (Grenz- oder Deckgewebe, das den Körper an Oberflächen von der Umgebung abgrenzt.(14)). Diese sind für die Viren nur an einem Epithelübergang, wie er in der Cervix oder im Oropharyngealbereich (insbesondere die Mandeln im Mund-Rachen Bereich) vorkommt, oder durch Verletzungen erreichbar. Die Expression, also die Umsetzung einer genetischen Information, und die Differenzierung der Viren ist streng an die Proliferation des Epithels gekoppelt. Freigesetzt werden die Viren schlussendlich durch Epithelabschilferung. Von der Basalzellschicht (s.o.) hin zur Oberfläche exprimiert die Epithelzelle nun zunächst die sogenannten „early Proteine“ E1-7, um abschließend im Stratum spinosum (bestimmter Abschnitt des Gewebes) die „Capsid Proteine“ L1 und L1 zu synthetisieren. Es erfolgt das Assembly, also das Zusammenbauen des Virus, und der Wirtszyklus findet seinen Abschluss.(15)
Auch bei asymptomatischen Verläufen besteht ein Übertragungsrisiko.(16)
Feigwarzen (Genitalwarzen, Condyloma acuminata) sind hochansteckende gutartige Hautwucherungen. Es sind wenige Millimeter bis mehrere Zentimeter große, spitze Warzen, die im Genitalbereich z.B. bei Frauen in der Vagina (und am Gebärmuttermund) sowie am und um den After auftreten können. Die weichen, warzigen Wucherungen sind rötlich, grau-bräunlich oder weißlich gefärbt. Feigwarzen können auch außerhalb des Genitalbereichs im Bereich der Haut und Schleimhaut (insbesondere Mund, bedingt durch Oralverkehr) vorkommen.
Abhängig von den Virustypen – vgl. Hochrisiko-HP-Viren – können Zellwucherungen auch maligne entarten (bösartige Zellwucherung – Krebs). Eine mögliche schwere Folge einer HPV-Infektion bei der Frau ist daher der Gebärmutterhalskrebs. Etwa 70 Prozent der Gebärmutterhalskrebserkrankungen werden durch die Hochrisiko-HPV-Typen 16 und 18 hervorgerufen. Es wird davon ausgegangen, dass insgesamt über 90% der Zervixkarzinome durch HPV (mit-)verursacht werden. Vorläuferläsionen können gut behandelt werden, vorausgesetzt, sie werden im Rahmen der Krebsfrüherkennungsuntersuchung (u.a. PAP-Test ab dem 20. Lebensjahr) rechtzeitig erkannt. Therapiemöglichkeiten siehe Abschnitt Therapie.
Näheres zu den Folgen einer Infektion siehe Abschnitte Therapie und Spätfolgen.
1.4 Immunreaktion
Was passiert im Körper nach der Ansteckung mit HPV? Wenn unser Körper mit Viren oder Erregern in Kontakt kommt, wird unser Immunsystem aktiv und versucht, diese Viren zu bekämpfen. Das Immunsystem hat hier verschiedene Wirkmechanismen, auch Immunreaktionen genannt. Wegen der unterschiedlichen Varianten des HP-Virus ist auch die Reaktion des Immunsystems ganz unterschiedlich. Allgemein werden HP-Viren vom Immunsystem nur schwer erkannt. Das hat ganz verschiedene Gründe, zum Beispiel, dass die Infektion immer an den oberen Zellschichten der Haut bzw. Schleimhaut bleibt, die kaum bis gar nicht durchblutet wird.
Eintrittspforte für eine Infektion mit HPV stellen die undifferenzierten Stammzellen in Epithelverbänden dar (17). Aus den 5 verschiedenen Klassen der HP-Viren (Alpha-, Beta-, Gamma-, Mu- und Nu-HPV) ist nur die α-Klasse dazu in der Lage, neben verhornenden Plattenepithelien auch das Schleimhautepithel zu infizieren. Die Reifung der Viren zur ausdifferenzierten virulenten Form nimmt dabei einen Zeitraum von ca. 3 Wochen ein. I.d.R. ist es für die lokale zelluläre Immunabwehr sehr schwierig, die HP-Viren adäquat zu erkennen und die Infektion einzudämmen. So schützt sich das Virus durch das späte Zusammenbauen der einzelnen Bestandteile vor einer Antigenerkennung; die Antigen-präsentierenden Zellen (APC) können also nur schwer eine Primärantwort einleiten. Insgesamt bleiben somit bis zu 20% der Infektionen mit einer bleibenden Zellveränderung bestehen, 1-2% aller Infektionen entwickeln ein Karzinom. Durch die anhaltende Infektion steigt das Risiko der zufälligen Integration der viralen DNA in die Epithelien, was mit einer möglichen Expression der Virusproteine E6 und E7 einhergeht. Diese können auf die Zellzyklusregulation einwirken und somit schlussendlich zur malignen Entartung führen. Als Marker ist hierbei das in dieser Phase erhöhte Tumorsuppressorgen p16INK4a (Regelmechanismen, die in den Zellzyklus eingreifen) bedeutsam(18). Die schlechte Erkennung der Viren durch körpereigene Abwehrzellen hat unterschiedliche Gründe: 1. Die Infektion bleibt stets intraepithelial. 2. Die Epidermis selbst wird nicht durchblutet, die Freisetzung erfolgt auf dem physiologischen Weg der Abschilferung. Interessant ist auch, dass 3. APC durch Viruspartikel nicht aktiviert werden. Es zeigen sich auch unterdrückende Effekte auf die Interferonausschüttung (körpereigener Signalstoff, der im Zusammenhang mit Infektionen gebildet wird(19)), ausgelöst durch die viralen Proteine E6 und E7. Vereinzelt gelingt jedoch die Antigenerkennung, sodass über MHCII-Komplexe die adaptive Immunantwort eingeleitet werden kann. Bemerkenswert ist, dass eine Seropositivität auf HPV-Antikörper nach durchgemachter Infektion nicht vor weiteren Infektionen schützt - dies liegt an dem allgemein sehr geringen Antikörpertiter. Ansatz der Immunisierung ist deshalb die Isolierung von Antigenepitopen der Proteinkapside. Diese sogenannten VLP’s (virus like particles) dienen nun der deutlich optimierten Ausbildung von Antikörpern. Wichtigste Vertreter sind hier die beiden Kapselproteine L1 und L2, sie unterscheiden sich abhängig der mittlerweile über 200 identifizierten Genotypen.(20)
1.5 Therapie
Wie behandelt man HPV? Wie eine Behandlung bei HPV aussieht, hängt davon ab, mit welcher Kategorie von HP-Virus man sich angesteckt hat. Nach einer Ansteckung mit Neidrigrisiko-Typen werden die Feigwarzen lokal behandelt. Bei einer Infektion mit Hochrisiko-Typen kann Krebs ausgelöst werden, was seine spezielle Therapie erfordert. Eine frühes Erkennen der Krankheit in Vorsorgeuntersuchungen ist essentiell. Rechtzeitig erkannt sind auch die frühen Formen einer durch HPV ausgelösten Krebserkrankung gut behandelbar. Folgende Therapiemethoden sind für die jeweiligen Krebsarten geläufig:
Bei einem Vaginalkarzinom besteht die Möglichkeit der operativen Entfernung des Tumors und/ oder die Bestrahlung. Ähnlich ist es beim Peniskarzinoms, wo abhängig vom Stadium und der Ausbreitung des Tumors eine operative Behandlung meist die erste Therapieoption ist. Auch beim Analkarzinom gibt es therapierbare Vorläuferläsionen. Krebs im Mund-Rachen-Raum, genauer gesagt in den Mandeln, wird Oropharyngealkarzinom genannt. Auch hier gibt es verschiedene mögliche Behandlungen. Welche sich am besten eignet, ermitteln Ärzte mit Gewebeproben. Gängige Behandlungsmethoden sind Operation, Bestrahlung oder Chemotherapie.
Weil HPV sexuell übertragbar ist, sollten auch Sexualpartner mit untersucht und behandelt werden.
Die möglichen Symptome und Folgen und damit Therapien unterscheiden sich bei den Hochrisiko- und Niedrigrisikotypen.
Niedrig- und Hochrisikovirustypen können zu Tumorvorläuferläsionen („Carcinoma in situ“, „intraepitheliale Läsionen“) führen. Insbesondere bei Beteiligung von Hochrisikovirustypen können diese Läsionen entarten und Karzinome entstehen. Feigwarzen entstehen durch Infektion mit den Niedrigrisikotypen 6 und 11, entarten i.d.R. nicht und werden lokal behandelt. Durch die Hochrisikotypen werden unter anderem Gebärmutterhals-, Vaginal-, Penis-, Anal- und Mund/Rachenkrebs ausgelöst (21). Unbehandelt kann eine Infektion mit einem HPV-Hockrisikotypen tödlich enden.
Man versucht, die durch die Viren verursachten Zellveränderungen in möglichst frühen Stadien zu therapieren. Zervikale intraepitheliale Neoplasien können schon im frühen Erwachsenenalter auftreten. Daher gibt es Vorsorgemaßnahmen z.B. die Zervixkarzinom-Früherkennung beim Frauenarzt, die für alle Frauen ab dem 20. Lebensjahr empfohlen ist und von der Krankenkasse übernommen wird. Diese beinhaltet einen Abstrich des Gebärmutterhalses und eine zytologische Untersuchung und ggf. HPV-Diagnostik.
Die Therapie der Feigwarzen (Condylomata acuminata, vorwiegend ausgelöst durch HPV 6,11) richtet sich nach der Anzahl der Läsionen, der Größe und der Lokalisation. Die unterschiedlichen Therapieoptionen sind in den Ergebnissen vergleichbar und müssen gemeinsam mit den Patienten abgewogen werden – u.a. abhängig von der Ausprägung der Läsionen und der Adhärenz/Compliance (erwartete Annahme und Durchführung der Therapie) der Patienten.
Unter anderem gibt es die Therapie mit lokal angewendeten Medikamenten als Salben, Cremes oder Lösungen, die über mehrere Wochen auf die äußeren, betroffenen Stellen aufgetragen werden müssen. Diese Salben beinhalten üblicherweise Wirkstoffe wie Imiquimod oder Podophyllotoxin. Alternativ kann die ärztliche Entfernung der Läsionen z.B. durch Elektrokauterisation, Kürettage, Lasertherapie, einer mechanischen, schichtweisen Abtragung, sowie einer wiederholten Anwendung von Trichloressigsäure des betroffenen Gewebes erfolgen.
Kommt es zu einer Diagnose und einer Therapie von Genitalwarzen, ist es zu empfehlen, den kompletten anogenitalen Bereiches auf das Vorhandensein anderer HPV assoziierter intraepithelialen Neoplasien untersuchen zu lassen. Gleichzeitig sollte, wie bei allen infektiösen Geschlechtskrankheiten (SID’s), auch der Sexualpartneruntersucht und ggf. mitbehandelt werden. Eine Nachsorge nach Therapie ist empfohlen.
Vorläuferläsionen der Karzinome/Dysplasien können sehr gut und vollständig therapiert werden. Dafür kann das Gewebe sowohl operativ entfernt werden, als auch von der Hautoberfläche entfernt werden- etwa mit Laser. Manchmal wird auch eine Kältetherapie eingesetzt. Alternativ oder als Kombination können ein Medikament mit dem Wirkstoff Imiquimod lokal angewendet werden. Aufgrund des hohen Rezidiv- und Entartungsrisikos von Vorstufen des Gebärmutterhalskrebs auch nach erfolgter Behandlung sind regelmäßige Kontrollen notwendig.(22) Eine Impfung nach erfolgter Therapie einer CIN scheint bei der Prävention (Vorbeugung) eines Rezidivs (Wiederauftreten der Krankheit) zu helfen.(23)
Für die Therapie von Gebärmutterhalskrebs stehen folgende Behandlungsmöglichkeiten zur Auswahl: Operation, Strahlentherapie und Chemotherapie.
Welche Therapie letztendlich durchgeführt wird, hängt von der Größe und der Ausbreitung des Tumors, Alter der Patientin, dem allgemeinen Gesundheitszustand und von einem eventuell bestehenden Kinderwunsch ab. Primär wird immer eine Operation angestrebt. Abhängig vom Tumorstadium (Staging) ist ab FIGO (Gynäkologische Tumor-Klassifikation) III eine primäre Radiochemotherapie indiziert. Befindet sich das Zervixkarzinom in einem frühen Krankheitsstadium, so fällt die Wahl meist auf die operative Therapie. Hierbei werden das Tumorgewebe und ggf. umliegendes Tumorgewebe und die befallenen Lymphknoten vollständig entfernt. Eine Probenentnahme und histologische Analyse des Tumors hilft ggf. bei der weiteren Therapieentscheidung. Ist der Tumor sehr klein und wurde früh erkannt, kann eine kegelförmige Ausschneidung (Konisation) an der Cervix durchgeführt werden. Ist dieses Verfahren nicht ausreichend, kann eine Teilamputation des Gebärmutterhalses (Trachelektomie) vorgenommen werden. Eine Schwangerschaft ist nach beiden Eingriffen noch möglich. Hat sich der Tumor bereits auf tiefere Gewebsschichten ausgebreitet, ist meist eine vollständige Entfernung der Gebärmutter (Hysterektomie) notwendig, was mit Infertilität (Unfähigkeit Kinder zur Welt zu bringen) einhergeht. Nach der Operation wird ggf., z. B. bei starkem Tumorbefall, zusätzlich eine Strahlentherapie, evtl. in Kombination mit einer Chemotherapie durchgeführt. Damit sollen eventuell im Körper zurückgebliebene Tumorzellen vernichtet werden und das Risiko eines Rückfalls gesenkt werden. Im fortgeschrittenen Stadium, z.B. bei Lymphknotenbefall (N+), allgemein ab FIGO III oder wenn eine operative Entfernung des Tumors nicht möglich ist, ist eine primäre Radiochemotherapie indiziert.
Bei einem Vaginalkarzinom besteht die Möglichkeit der operativen Entfernung des Tumors und/ oder die Bestrahlung. Das anzuwendende Therapieverfahren richtet sich immer nach dem Stadium bzw. der Ausbreitung des Tumors. Es wird immer eine primäre radikale Entfernung des Tumorgewebes angestrebt. Bei größeren Karzinomen kann es unter Umständen zu einer kompletten Entfernung der Vagina sowie anderer Organe wie Harnblase und Darm oder auch nahe gelegener Lymphknoten im Bauch-, Becken- und Leistenbereich kommen. Aufgrund dessen wird in fortgeschrittenen Fällen (individuelle Entscheidung ab T2/T3) die Strahlentherapie und ggf. Chemotherapie angewendet. Beim operativen Ansatz ist i.d.R. eine Testung der Lymphknoten (Lymphknotenstaging) auf Tumorbefall angezeigt und bei einseitigem Befall eine beidseitige Lymphknotenentfernung notwendig. Eine Bestrahlung (Radiatio) ist bei unvollständiger operativer Entfernung oder ausgeprägtem Lymphknotenbefall empfohlen. Die Prognose des Vaginalkarzinoms ist insgesamt schlecht.(24)
Die Therapie des Peniskarzinoms ist abhängig vom Stadium und der Ausbreitung des Tumors. Eine operative Behandlung ist meist die erste Therapieoption. Je nach Ausmaß reicht die Operation von der Entfernung des Tumors (partielle Penektomie, möglich bei 1 cm Sicherheitsabstand und postoperativ gerichteter Miktion) bis zur kompletten Penisamputation. Ein Urinieren ist im letzten Fall nur bei Ausleitung der Harnröhre über den Damm möglich. Sollte beim Staging festgestellt werden, dass sich Metastasen in den Lymphknoten gebildet haben, werden die nahegelegenen Lymphknoten mit entfernt. Eine inguinale Lymphknotenektomie (Entfernung der Lymphknoten in der Leistengegend) ist bei vergrößerten Leistenlymphknoten und allen invasiven Peniskarzinomen indiziert (ab T2-Stadium). Der Einsatz von Chemotherapie und Strahlentherapie kommt auch in einem fortgeschrittenen Stadium und Metastasierung zum Einsatz – die Prognose ist dann infaust (äußerst ungünstig, in der Folge tödlich).(25)
Auch beim Analkarzinom gibt es therapierbare Vorläuferläsionen. Diese schonenden Therapieoptionen entsprechen ungefähr denen der Vorläuferläsionen bei Befall der Vagina (siehe entsprechendes Kapitel) und sollen eine Entfernung von verändertem Gewebe bei gleichzeitigem Schutz des umliegenden Gewebes und der betroffenen Gefäße ermöglichen.
Bei Manifestation eines Karzinoms wird i.d.R. mit einer Radiochemotherapie begonnen (Chemotherapeutika u.a. 5-FU und Mitomycin). Wenn möglich, wird eine Operation angeschlossen – ggf. eine lokale Exzision mit 1cm Sicherheitsabstand oder eine „Salvage-Operation“.
Das 5-Jahres-Überleben beträgt 80%, wenn die Analkarzinome noch mit alleiniger Radiochemotherapie behandelbar sind.(26)
Beim Oropharyngealkarzinom können verschiedene Therapien in Betracht gezogen werden. Besteht ein verdächtiger Befund im Mund-Rachen-Raum muss nach spätestens drei Monaten Beobachtungszeit eine Gewebeuntersuchung durchgeführt werden. An gut zugänglichen Stellen, wie bspw. Mundhöhle, Zunge oder Gaumenmandeln, können Veränderungen in Form einer Gewebeprobe in örtlicher Betäubung entnommen werden. Sollte es sich bei diesem Gewebe eindeutig um einen Tumor handeln, wird dieser direkt biopsiert (Entnahme von Probengewebe zur weiteren Analyse). Anhand des Ergebnisses der Gewebeprobe stehen Therapieverfahren wie Operation, Bestrahlung und Chemotherapie zur Verfügung. Studien zeigen, dass sowohl eine kombinierte Therapie aus Operation und Bestrahlung als auch eine alleinige Strahlentherapie oder alleinige Operation sowie mit zusätzlicher Chemotherapie verbunden eine vergleichbar günstige Prognose aufzeigen.
Aufgrund dessen gibt es bisher keinen sicheren Konsens über die optimale Therapie von HPV assoziierten Oropharynxkarzinomen. Der Nachweis einer HPV-Infektion der Tumorzellen ermöglicht eine bessere Prognose und ist daher in jedem Fall zu erbringen. Je nach Tumorausbreitung ist mit signifikanten Einschränkungen zu rechnen und eine lange Rehabilitation notwendig.
1.6 Spätfolgen einer Infektion
Condylomata acuminata:
Genitalwarzen sind eine primär benigne (gutartige) Erkrankung. Zu über 90% werden die Niedrigrisiko-HPV-Typen 6 und 11 als Krankheitsauslöser verantwortlich gemacht. Für beide Geschlechter wird von einem Lebenszeitrisiko von 5-10% ausgegangen. Eine Infektion mit einem Niedrigrisiko-HPV-Typ kann zu Genitalwarzen (Condylomata acuminata), auch Feigwarzen genannt, führen. Diese stellen die häufigste HPV-assoziierte Erkrankung im äußeren anogenitalen Bereich dar und werden als sehr störend empfunden. Hierbei handelt es sich um gutartige Hautwucherungen - meist stecknadelkopfgroße, rötlich oder bräunlich gefärbte Knötchen. Genitalwarzen bilden zunächst einzelne, dann Beet-artig angeordnete kleine Papeln auf der Haut im Intimbereich. Sie können sowohl bei Frauen als auch bei Männern im Genitalbereich auftreten. In der Regel sind Genitalwarzen im Anfangsstadium symptomlos. Mäßiger Juckreiz und kleinere Blutungen können beim weiteren Wachstum auftreten.
Durch eine Übertragung während der Geburt können beim Neugeborenen Larynxpapillome (Kehlkopfpapillome) entstehen.27
Dysplasien und Vorläuferläsionen:
HP-Viren führen zu Zellveränderungen/Dysplasien. Überschreiten diese noch nicht die Basalmembran bzw. sind nicht-invasiv, werden sie „intraepitheliale Neoplasien oder Läsionen“ genannt, können aber auch entarten und in der Folge invasiv wachsen. Die zervikale intraepitheliale Neoplasie (CIN) ist demnach der Vorläufer eines invasiven Zervixkarzinoms. Die Einteilung erfolgt anhand der Zervixzytologie nach Papanicolaou (Pap-Abstrich) und anhand des Biopsie-Befundes histologisch nach der CIN-Klassifikation der zervikalen intraepithelialen Neoplasien (abhängig von der Ausbreitung der veränderten Zellen in der Schleimhaut, z.B. CIN III: Ausbreitung bis in die Epitheloberfläche). Bei Früherkennungsuntersuchungen auf Gebärmutterhalskrebs können diese Gewebeveränderungen (Dysplasien) am Muttermund entdeckt werden.
Für die anderen Lokalisationen der im folgenden gelisteten Tumore gibt es ähnliche Klassifikationen der Vorläuferläsionen.
Zervixkarzinom:
Das Zervixkarzinom stellt einen bösartigen Tumor am Gebärmutterhals dar. Das Zervixkarzinom ist i.d.R. zunächst symptomlos. Erst ab einer gewissen Größe kommt es zu unterschiedlichen Beschwerden, wie beispielsweise: unregelmäßige Blutabgänge, fleischwasserfarben-blutiger Fluor, Kontaktblutungen und Schmerzen.
Oropharynxkarzinom:
Das Oropharynxkarzinom ist ein bösartiger Schleimhauttumor des Mund-Rachenraumes. Im Bestfall bemerkt der Patient zunächst tastbare oder sichtbare Unebenheiten, weißlich-belegte Stellen oder leichte Missempfindungen. Ungünstig gelegene und damit nicht sichtbare Tumore können nach unmerklichem Wachstum ggf. zu lokalen Missempfindungen, Schluckbeschwerden, Schmerzen, Sickerblutungen und Atembeschwerden führen. Meist sind schmerzlose Lymphknotenschwellungen (Lymphabflussgebiet des Oropharynx) am seitlichen Hals die ersten Symptome.
Peniskarzinom:
Beim Peniskarzinom handelt es sich um einen bösartigen Tumor, welcher in der Regel an der Vorhaut und/oder der Eichel auftritt. Es ist möglich, dass sich das Karzinom im fortgeschrittenen Stadium auf die Schwellkörper bis hin zur Bauchdecke ausbreitet. Bei den äußeren Symptomen handelt es sich um Knoten und Verhornungen der Haut. Da diese Hautveränderungen nur selten als eine ernsthafte Krankheit wahrgenommen werden, wird der Peniskrebs oftmals erst zu spät behandelt. Da beim wachsenden Peniskarzinom anfangs meist keine Schmerzen auftreten, gehen viele Betroffene zu spät zum Arzt. Bei Peniskarzinomen wurde eine HPV-Prävalenz von 30-46% festgestellt, was im Jahr 2013 in Deutschland zwischen 250 und 360 HPV-assoziierten neuen Diagnosen entsprechen würde.28
Vaginalkarzinom:
Vaginalkarzinome stellen seltene bösartige Veränderungen an der Scheide dar. Erst in einem fortgeschrittenen Stadium entwickeln sich die ersten Symptome. Auffälligkeiten können sich beispielsweise in blutigem Ausfluss und Vaginalblutungen z.B. nach Sexualkontakt äußern. Bei einer Ausbreitung des Tumors auf das umliegende Gewebe oder weitere Organe können sich Tumore mit Unterleibsschmerzen oder Organstörungen der Harnblase und des Darms bemerkbar machen.
Vulvakarzinom:
Der Vulvakrebs ist eine seltene bösartige Tumorerkrankung der äußeren Geschlechtsorgane der Frau. Am häufigsten betroffen sind die großen Schamlippen, seltener auch die kleinen Schamlippen oder die Klitoris. Am häufigsten klagen Betroffene über Juckreiz, Brennen und Schmerzen beim Wasserlassen, blutigen Ausfluss oder kleine eventuell rote Verhärtungen oder Flecken, die an Warzen und Narben erinnern. In den meisten Fällen wird das Vulvakarzinom erst symptomatisch, nachdem es sichtbar geworden ist. Diese sichtbaren Symptome sind beispielsweise spürbare Knoten oder Geschwüre mit blumenkohlartiger Oberfläche.
Analkarzinom:
Bei einem Analkarzinom handelt es sich um einen bösartigen Tumor des Analkanals und stellt eine seltene, aber in ihrer Häufigkeit zunehmende Krebsart dar. Vorstufen des Analkarzinoms treten häufig in Form von hautfarbenen bis rötlichen, warzenähnlichen Knötchen im Analkanal oder am Analrand auf. Zu den möglichen Symptomen zählen Jucken, spontane Blutungen, Schmerzen (vor allem beim Stuhlgang), das Absondern von Schleim oder/und unregelmäßige Stuhlgänge. Oft entsteht ein Karzinom dieser Region aber ohne erkennbare Symptome. Der Anteil der HPV-assoziierten Analkarzinome an allen Analkarzinomen wird auf >80% geschätzt. Bezogen auf diese Prävalenz wird geschätzt, dass in Deutschland jedes Jahr etwa 600 HPV-attributable Analkarzinome bei Männern auftreten.29
2. Der Impfstoff
Es gibt drei verschiedene Impfstoffe gegen HPV: Gardasil, Gardasil 9 und Cervarix. Alle drei Impfstoffe werden für die Verwendung ab einem Alter von 9 Jahren bei Jungen und Mädchen empfohlen.30 Die Impfstoffe sind so aufgebaut, dass sie vor allem vor den krebserregenden Typen von HPV aus der Hochrisikogruppe entgegenwirken. Bei Kindern und Jugendlichen übernimmt die Krankenkasse die Kosten für die Impfung. Für Erwachsene wird empfohlen, vorab bei der Krankenkasse nachzufragen, ob die Kosten übernommen werden können.
Am 20.09.2006 wurde der Impfstoff Gardasil als erster HPV-Impfstoff zugelassen. Es handelt sich hierbei um einen viervalenten Impfstoff, der vor den 4 Hochrisiko-HPV-Typen 6, 11, 16 und 18 schützt. Die später zugelassenen Impfstoffe Cervarix und Gardasil 9 tragen allerdings effektiver zur Ausbildung von Antikörpern bei.
Gardasil wurde mittlerweile weitgehend durch den neunvalenten Impfstoff Gardasil 9 ersetzt, der im Jahr 2015 zugelassen wurde. Neben HPV 16 und 18 schützt er außerdem vor den HP-Viren 31, 33, 45, 52 und 58 sowie gegen die HPV-Typen 6 und 11, die für etwa 90% der auftretenden Genitalwarzen verantwortlich gemacht werden. Gardasil 9 ist zur Prävention von Vorstufen maligner Läsionen und Karzinome, die Zervix, Vulva, Vagina und Anus betreffen sowie von Genitalwarzen, welche durch HPV-Infektionen hervorgerufen werden, indiziert. Der Impfstoff wird normalerweise in einem 2-Impfdosenschema bei Jungen und Mädchen zwischen 9 und 14 Jahren und einem 3-Impfdosenschema ab einem Alter von 15 Jahren verabreicht. Die zweite Impfdosis sollte zwischen 5 und 13 Monaten nach der ersten Dosis verabreicht werden.
Cervarix ist ein bivalenter Impfstoff, der vor den HPV-Typen 16 und 18 schützt. Diese beiden HPV-Typen verursachen etwa 70% der Zervix- und 90% der Analkarzinome. Es konnte gezeigt werden, dass Cervarix abnormales Zellwachstum in der Zervix effektiver vorbeugt als der ursprünglich etablierte Impfstoff. Ceravix weist unter den genannten Impfstoffen die geringste Dosis an Antigenen auf, ferner enthält er AS04, einen Stimulator des Toll-like-Rezeptor 4, wodurch die Immunogenität erhöht wird. Toll-like-Rezeptoren erkennen Pathogene und aktivieren das Immunsystem.
Bis zum 18. Lebensjahr werden die Kosten von den Krankenkassen übernommen. Wenn man sich nach der Vollendung des 18. Lebensjahres impfen möchte, empfiehlt es sich, Kontakt zur Krankenkasse aufzunehmen und nach einer Kostenübernahme zu fragen.(31) Die Kosten belaufen sich laut Arzneimittelverordnungsreport 2009 ungefähr auf 480 Euro pro Impfung.
2.1 Wirkmechanismus
Kurz erklärt: Die Impfstoffe gegen HPV enthalten Teilchen, die dem Virus sehr ähnlich sind. Das Immunsystem wird damit vorbereitet, sich zu wehren, wenn es mit dem HPV Erreger in Kontakt kommt. Durch die Impfung kann das Immunsystem leichter Antikörper bilden. Die vielen HPV-Typen und die unterschiedlichen Impfstoffe verringern den Ausbruch der Krankheit. Je nach Virustyp und Impfstoff liegt der Schutz bei bis zu 95%.
Die HPV-Impfstoffe enthalten hochgereinigte virusähnliche Partikel des Hauptkapsidproteins L1 der jeweiligen HPV-Typen. Erhält ein Patient ein Impfdosis, erkennt der Körper die L1 Proteine und bildet spezifische Antikörper, wodurch im Falle einer tatsächlichen Infektion mit dem Virus der Erreger schneller beseitigt werden kann.
Die virusähnlichen Partikeln (VLPs) sind nicht in der Lage, Zellen zu infizieren, sich zu vermehren oder Erkrankungen hervorzurufen. Die Genotypen für die im Impfstoff enthaltenen HPV-Typen 6, 11, 16, 18, 31, 33, 45, 52, 58 werden als Impfstoff-HPV-Typen bezeichnet. Basierend auf epidemiologischen Studien nimmt man an, dass Gardasil 9 vor den HPV-Typen schützt, die verantwortlich sind für etwa 90 % der Zervixkarzinome, mehr als 95 % der lokal auftretenden bösartigen Tumore in Drüsengewebe (AIS), 75 bis 85 % der hochgradigen intraepithelialen Neoplasien der Zervix (CIN2 2/3), 85 bis 90 % der mit HPV assoziierten Vulvakarzinome, 90 bis 95 % der mit HPV assoziierten hochgradigen intraepithelialen Neoplasien der Vulva (VIN3 2/3), 80 bis 85 % der mit HPV assoziierten Vaginalkarzinome, 75 bis 85 % der mit HPV assoziierten hochgradigen intraepithelialen Neoplasien der Vagina (VaIN4 2/3), 90 bis 95 % der mit HPV assoziierten Analkarzinome, 85 bis 90 % der hochgradigen intraepithelialen Neoplasien des Anus (AIN5 2/3) und 90 % der Genitalwarzen.(32)
In den bisherigen Studien mit >25.000 Probanden konnten bereits nach der ersten Immunisierung hohe Antikörpertiter bei >99,9% der Geimpften nachgewiesen werden.(33)
Die Antikörpertiter sind dabei in der Regel deutlich höher als nach durchgemachter Infektion. Allerdings zeigen sich in Follow-up Studien deutliche Unterschiede zwischen den einzelnen HPV Typen. Für den Hochrisikotyp 16 konnte nichtsdestotrotz eine langjährige Wirksamkeit bestätigt werden.
2.2 Inhaltsstoffe und Herstellung
Impfstoffe können sehr empfindlich sein. Die aktuell verfügbaren Impfstoffe bestehen aus verschiedenen Zutaten. Neben den virusähnlichen Partikeln sind z.B. auch Wasser und Kochsalz enthalten. Damit der Impfstoff gut wirkt, muss man ihn pausenlos kühlen. Gerade für den Transport und Einsatz in wärmeren Ländern kann das eine Herausforderung werden.
Zusammensetzung des Impfstoffes Gardasil 9:
L1-Protein der HPV Typ 6 – 11 –16 –18 – 31 – 33 – 45 – 52 – 58
Weitere Bestandteile des Impfstoffes Gardasil 9:
- Natriumchlorid
- Histidin
- Polysorbat 80
- Natriumtetraborat x 10 H2O
- Wasser für Injektionszwecke
- 500µg Amorphous aluminum hydroxyphosphate sulfate(34)
Die aktuellen Impfstoffe sind aufwendig in der Herstellung sowie hitzeempfindlich und müssen daher gekühlt werden. Die aktuelle impfpräventive Versorgung kann nur durch die Aufrechterhaltung einer Kühlkette erfolgen und macht die Impfung in Entwicklungsländern, insbesondere am Äquator, fast unmöglich. Derzeit wird daher nach einem neuen Impfstoff geforscht, der eine Thermostabilität aufweist, kostengünstiger ist und gegen alle HPV-Typen schützen soll.
Auch Cevarix und Gardasil enthalten Aluminium (500 und 225µg).
2.3 Impfwirkungen und -nebenwirkungen
Die Impfstoffe gegen HPV sind inzwischen gut erforscht. Wie bei vielen anderen Medikamenten kann es auch nach einer Impfung gegen HPV zu Nebenwirkungen wie zum Beispiel Kopfschmerzen kommen.
Genauer erklärt: Eine Evaluation des Impfstoffes hat ergeben, dass der Impfstoff Gardasil 9 gut verträglich ist. Die häufigste Nebenwirkung, die nach einer Impfung mit Gardasil 9 festgestellt wurde, waren Reaktionen an der Infektionsstelle (84% der geimpften Probanden) und Kopfschmerzen (13,2% der geimpften Probanden). Diese Nebenwirkungen sind leicht bis mittelschwer und heilen nach einigen Tagen folgenlos aus.(35) Die meisten Nebenwirkungen sind im Rahmen der Immunreaktion als normal zu bewerten (Affinitätsreifung der AK).
| Systemorganklasse | Häufigkeit | Nebenwirkungen |
|---|---|---|
| Erkrankungen des Nervensystems | Sehr häufig | Kopfschmerz |
| Häufig | Schwindel | |
| Erkrankungen des Verdauungstraktes | Häufig | Übelkeit |
| Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | Sehr häufig | Injektionsstelle: Schmerz, Schwellung, Erythem |
| Häufig | Fieber, Abgeschlagenheit An der Injektionsstelle: Pruritus, Einblutung |
Tab.: Nebenwirkungen nach Anwendung des Impfstoffes Gardasil 9® abgeleitet aus 7 klinischen Studien und einer Teilnehmerzahl von 15.776 (36)
Bezüglich der Wirksamkeit von Gardasil 9 sind zwei großangelegte qualitativ hochwertige Studien durchgeführt worden. Diese Studien waren sogenannte RCT-Studien, also randomisiert kontrollierte Studien (FUTURE I und II).
Die Studie kommt zu dem Ergebnis, dass die Impfung in 97-100% der HPV 16 und 18 assoziierten Gebärmutterhalskrebsvorstufen mit vorheriger HPV 16/18 negativer Befundung oder vollständiger Impfserie eine Wirksamkeit zeigt. Auf alle HPV-Typen bezogen, kann die Impfung die Inzidenz von Gebärmutterhalskrebs senken. Der Nutzen einer durchgeführten Impfung sinkt, wenn zuvor bereits eine Infektion mit dem geimpften HPV-Typ vorlag.(37)
3. Aktuelles
Seit Juni 2018 empfiehlt die STIKO die HPV-Impfung für Jungen analog zu Mädchen im Alter von 9-14 Jahren (Nachholimpfung bis zum Alter von 17 Jahren). Die Empfehlung zur HPV-Impfung für Mädchen besteht bereits seit 2007. Diese neue Empfehlung ist bisher wenigen Jugendlichen bekannt, so dass die Impfquote der Jungen aktuell gering ist.
4. Auffrischung und Impfung im späteren Lebensalter
Nach heutigem Wissensstand wird bis auf weiteres keine Auffrischung der Impfung benötigt. Es zeigen sich auch noch nach Jahren sehr hohe AK-Titer. Da die Impfung allerdings erst seit einigen Jahren auf dem Markt ist, könnten sich hier noch andere Aussagen ergeben. Die unterschiedlichen Impfstoffe zeigen jedoch erhebliche Unterschiede bezüglich der HPV-Typen-Wirksamkeit. Die Impfstoffe sind außerdem rein prophylaktisch wirksam.38
5. STIKO-Stellungnahme
Zur Reduktion der Krankheitslast durch bestimmte HPV-assoziierte Tumore empfiehlt die Ständige Impfkommission (STIKO) am Robert Koch-Institut eine generelle Impfung gegen humane Papillomviren (HPV) für alle Mädchen und Jungen im Alter von 9 bis einschließlich 14 Jahren. Nachholimpfungen werden bis zum Alter von 17 Jahren empfohlen. Die vollständige Impfserie sollte vor dem ersten sexuellen Kontakt abgeschlossen sein.39 Auch danach ist eine Impfung sinnvoll.
„Insbesondere begrüßt die STIKO, dass die Stiftung Warentest zu Recht zu einer positiven Einschätzung der Schutzimpfung gegen Humane Papillomviren (HPV) kommt. Aktuelle Daten aus Studien und der weltweiten Anwendung der Impfung in den letzten Jahren konnten die Studienergebnisse, die der STIKO zur Bewertung der Impfung gegen HPV vorlagen, bestätigen. Die STIKO empfiehlt die HPV-Impfung seit 2007 für alle Mädchen und jungen Frauen im Alter von 12 bis 17 Jahren. Leider kam es in Deutschland nach einer kontroversen Diskussion über den Nutzen der HPV-Impfung zu einer bisher nur mäßigen Akzeptanz der Impfung mit niedrigen Impfquoten. Das Potenzial der Impfung, in Zukunft Behandlungsbedürftige Krebsvorstufen am Gebärmutterhals, invasive Karzinome und damit Todesfälle zu verhindern, wird somit in Deutschland bislang nicht ausgeschöpft.“40
6. Impfempfehlungen in anderen Ländern
Die Impfung ist weltweit in das Impfprogramm von über 80 Ländern eingegangen. Die WHO hat das Ziel, den Gebärmutterhalskrebs mittels weltweiter Impfung auszurotten. Australien hat frühzeitig auf die freiwillige Schulimpfung gesetzt und hat damit heute kaum noch Feigwarzen in der jugendlichen Bevölkerung. Auch die Dysplasien sind deutlich rückläufig, so dass Australien wahrscheinlich das erste Land sein wird, welches in naher Zukunft kaum mit Gebärmutterhalskrebs konfrontiert sein wird. Die HPV-Impfung für Jungen und Mädchen wird in europäischen Ländern wie Italien, Österreich und der Schweiz schon seit längerem empfohlen. Untersuchungen aus England, Schweden und Australien weisen nach, dass die Anzahl HPV bedingter Läsionen deutlich gesenkt werden können.41 Deutschland liegt mit der Impfquote auch in Europa im hinteren Drittel.
Beispielsweise ist seit 2018 in Dänemark die HPV-Impfung fester Bestandteil des pädiatrischen Impfkalenders. Seitdem konnte die Vorstufe des Gebärmutterhalskrebses um 40% gesenkt werden.42 In England werden Mädchen im Alter zwischen 12 und 13 Jahren seit 2018 zur freiwilligen Schulimpfung eingeladen.43 Ab dem Schuljahr 2019/2020 soll es auch für Jungen in England möglich sein, die Impfung in der Schule zu erhalten.44 In Schweden wurde ab 2010 die HPV-Impfung Bestandteil des landesweiten Programms zur Schulgesundheit.45
7. Weiterführende Literatur
- Online-Impflexion: https://impflexikon.preventa.de/
- Online-Impflexikon für Kinder: https://meine-gesundheit.preventa.de/
- Schulimpfprojekt: https://ja-ich-auch.preventa.de/zum-thema-impfen/
- S3-Leitlinie zur Impfprävention HPV-assoziierter Neoplasien:https://www.awmf.org/leitlinien/detail/ll/082-002.html
- dkfz Krebsinformationsdienst: Humane Papillomviren (HPV) https://www.krebsinformationsdienst.de/vorbeugung/risiken/hpv.php
- Faktenblatt zur HPV-Impfung: https://www.rki.de/DE/Content/Infekt/Impfen/Materialien/Faktenblaetter/HPV.pdf?__blob=publicationFile
8. Quellen
[2] https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_HPV.html#doc11064408bobodyTe9 (abgerufen: 09.11.2020) Erregertypen, RKI-Ratgeber
[3] https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_HPV.html (abgerufen: 02.09.2020) Humanen Papillomviren, RKI-Ratgeber.
[4] Glastetter, E., Kaufmann, A. Humorale und zelluläre Immunantwort im Rahmen der HPV-Impfung. Hautarzt 58, 493–500 (2007). https://doi.org/10.1007/s00105-007-1339-4
[5] https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_HPV.html (abgerufen: 19.10.2020) Humanen Papillomviren, RKI-Ratgeber.
[6]https://www.krebsdaten.de/Krebs/DE/Content/Krebsarten/Gebaermutterhalskrebs/gebaermutterhalskrebs_node.html (09.11.2020) Daten zum Zervixkarzinom, Statistik
[7] ebd.
[8] https://next.amboss.com/de/article/ZO0ZIT#Yfe7a4ebd12904c3078f1c6957c9de35f - Artikel auf „Amboss“: Zervixkarzinom – Risikofaktoren (abgerufen: 19.10.2020)
[9] https://next.amboss.com/de/article/ZO0ZIT#Yfe7a4ebd12904c3078f1c6957c9de35f - Artikel auf „Amboss“: Zervixkarzinom – Risikofaktoren (abgerufen: 19.10.2020)
[10]https://www.frauenaerzte-im-netz.de/erkrankungen/humane-papillomviren-hpv/risikofaktoren/#:~:text=Humane%20Papillomviren%3A%20Risikofaktoren&text=Da%20HP%2DViren%20meist%20beim,Sexualverhalten%20des%20Partners%20eine%20Rolle.(abgerufen: 02.09.2020) Humane Papillomviren: Risikofaktoren, Berufsverband der Frauenärzte e.V. (BVF)
[11] https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_HPV.html (abgerufen: 02.09.2020) Humanen Papillomviren, RKI-Ratgeber.
[12] mit HPV-Infektion durch Oralsex wohl eher selten. CME 16, 6 (2019). https://doi.org/10.1007/s11298-019-7112-z
[13] https://next.amboss.com/de/article/zO0rET#yPbdhF - Infektion mit humanen Papillomaviren (abgerufen: 19.10.2020) und https://next.amboss.com/de/article/ZO0ZIT - Zervixkarzinom (abgerufen: 19.10.2020)
[14] https://flexikon.doccheck.com/de/Epithel (abgerufen: 09.11.2020) Begriffsklärung
[15] Glastetter, E. & Kaufmann, Andreas. (2007). Humorale und zelluläre Immunantwort im Rahmen der HPV-Impfung. https://www.researchgate.net/publication/225550970_Humorale_und_zellulare_Immunantwort_im_Rahmen_der_HPV-Impfung (abgerufen: 09.11.2020)
[16] Gross et al.: HPV-assoziierte Läsionen der äußeren Genitalregion und des Anus – Genitalwarzen und Krebsvorstufen der Vulva, des Penis und der peri- und intraanalen Haut. PEG (Paul-Ehrlich-Gesellschaft für Chemotherapie e.V. ). Stand: 2017. Abgerufen am: 30.07.2018. siehe auch https://doi.org/10.1111/ddg.13441_g
[17] ebd.
[18] Missaoui N, Mestiri S, Bdioui A, et al. HPV infection and p16INK4A and TP53 expression in rare cancers of the uterine cervix. Pathol Res Pract. 2018 https://doi.org/10.1016/j.prp.2018.03.004
[19] https://flexikon.doccheck.com/de/Interferon (abgerufen: 09.11.2020) Begriffsklärung
[20] vgl hierzu: https://www.researchgate.net/publication/225550970_Humorale_und_zellulare_Immunantwort_im_Rahmen_der_HPV-Impfung/link/02e7e51c9bff016f5f000000/download (abgerufen: 09.11.2020)
[21] https://vulvakarzinom-shg.de/fachinformationen-vulvakarzinom/humane-pappilomviren-hpv/ (abgerufen: 09.11.2020) Hochrisiko-HPV
[22] https://next.amboss.com/de/article/zO0rET#04be3F „Amboss”: Infektion mit humanen Papillomaviren – Therapie (abgerufen: 19.10.2020)
https://www.awmf.org/uploads/tx_szleitlinien/082-008l_S2k_HPV_assoziierte_anogenitale_L%C3%A4sionen_2017-11.pdf
[23] Kang, W. D., Choi, H. S. und Kim, S. M. (2013). Is vaccination with quadrivalent HPV vaccine after loop electrosurgical excision procedure effective in preventing recurrence in patients with high-grade cervical intraepithelial neoplasia (CIN2-3)? Gynecol Oncol 130, 264-268, doi: 10.1016/j.ygyno.2013.04.050.
[24] https://next.amboss.com/de/article/bO0HIT#oUb0VG – „Amboss“: Vulvakarzinom – Therapie (abgerufen: 19.10.2020)
[25] https://next.amboss.com/de/article/ri0fGf#Eya8SM – „Amboss”: Peniskarzinom – Therapie (abgerufen: 19.10.2020)
[26] https://next.amboss.com/de/article/gS0F_2#1C02IR – „Amboss”: Analkarzinom – Therapie (abgerufen: 19.10.2020)
[27] https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_HPV.html (abgerufen: 02.09.2020) Humanen Papillomviren, RKI-Ratgeber.
[28] Epidemiologisches Bulletin 26/2018 (PDF, 806 KB, Datei ist barrierefrei⁄barrierearm)https://www.rki.de/DE/Content/Infekt/EpidBull/Archiv/2018/Ausgaben/26_18.pdf?__blob=publicationFile (abgerufen: 09.11.2020)
[29]ebd.
[30] ebd. s.S. 7
[31] https://www.krankenkasseninfo.de/test/hpv (abgerufen: 09.11.2020) vergleichende Kostenübernahme
[32] https://www.msd.de/fileadmin/files/fachinformationen/gardasil_9.pdf (abgerufen: 02.09.2020) Fachinformation (Zusammenfassung der Merkmale der Arzneimittels), MSD
[33] S3 – Leitlinie Prävention des Zervixkarzinoms S. 44 https://www.awmf.org/uploads/tx_szleitlinien/015-027OLl_Praevention_Zervixkarzinom_2020-03.pdf (abgerufen: 10.09.2020)
[34] https://www.ema.europa.eu/en/documents/product-information/gardasil-9-epar-product-information_en.pdf (abgerufen: 09.11.2020) – Informationen zu Gardasil9
[35]vgl. S3 – Leitlinie Prävention des Zervixkarzinoms
[36] https://zervita.de/share/Impfstoffe/FI_GARDASIL-9_06-2015_RLFS.PDF#:~:text=Tabelle%201%3A%20Nebenwirkungen%20aus%20klinischen%20Studien%20nach%20Anwendung,des%20Gastrointestinaltrakts%20H%C3%A4ufig%20%C3%9Cbelkeit%20Allgemeine%20Erkrankungen%20und%20Be- (abgerufen: 09.11.2020) - Impfreaktionen
[37] https://www.rki.de/DE/Content/Infekt/EpidBull/Archiv/2018/Ausgaben/26_18.pdf?__blob=publicationFile (abgerufen: 09.11.2020)
[38] https://www.sciencedirect.com/science/article/pii/S0090825817307746 - S.5/9 Table2 (abgerufen: 09.11.2020)
[39] https://www.msd.de/fileadmin/files/fachinformationen/gardasil_9.pdf (abgerufen: 02.09.2020) Fachinformation (Zusammenfassung der Merkmale der Arzneimittels), MSD
[40] https://www.rki.de/DE/Content/Kommissionen/STIKO/stiko_kommentar_stiftung_warentest.html (abgerufen: 02.09.2020) STIKO-Stellungnahme zur Entscheidungshilfe zu Kinderimpfungen von Stiftung Warentest 3/2012, RKI-Ratgeber.
[41] Vgl. MSD Sharp&Dohme GmbH (o.A.), S. 14
[42] ebd.
[43] ebd.
[44] Vgl. National Health Service (2017), S.o.A.
[45] Vgl. Ärztezeitung (2009), S. o. A.
9. Impressum und Hinweise zur Nutzung
Die Zusammenstellung „HPV“ dient als Hintergrundinformation für den Gesundheitsunterricht in Schulen (z.B. Projekte „Impf-Dich“ und „Ein Projekt macht Schule“ mit „Meine Gesundheit in meinen Händen“) und hier für den persönlichen Gebrauch der Personen, die den Gesundheitsunterricht gestalten und lehren.
Die Zusammenstellung erfolgte durch das Team der gemeinnützigen preventa Stiftung (www.preventa.de) mit Hilfe des gemeinnützigen Vereins Gesundheitsnetz Rhein-Neckar (www.GNRN.de) und den Studierenden des Vereins Impfaufklärung in Deutschland e.V. (www.impf-dich.org).
Die Medizin unterliegt einem ständigen Entwicklungsprozess, sodass die Angaben, insbesondere zu diagnostischen und therapeutischen Verfahren, immer nur dem Wissensstand zurzeit der verfassten Version entsprechen können. Hinsichtlich der Zusammenstellung wurde die größtmögliche Sorgfalt beachtet. Gleichwohl werden die Benutzer aufgefordert, die Beipackzettel und Fachinformationen der Hersteller zur Kontrolle heranzuziehen und im Zweifelsfall einen Spezialisten zu konsultieren. Der Leser selbst bleibt verantwortlich für jede diagnostische und therapeutische Beratung, Applikation, Medikation und Dosierung. Medizinische und redaktionelle Unstimmigkeiten sollen bitte im allgemeinen Interesse mitgeteilt werden, damit diese schnell korrigiert werden können: kontakt@preventa.de